浓酸对金属腐蚀钝化现象
2019-4-13 11:54:23 点击:
某些活泼金属或其合金表面在某些介质环境下会发生一种阳极反应受阻的现象,其电化学性能接近于贵金属。金属的这种失去了原来的化学活性的现象被称为钝化,金属钝化后所获得的耐蚀性质称为钝性。钝化大大降低了金属的腐蚀速度,增加了金属的耐蚀性。
金属的钝化现象早在20世纪初就被人们发现。例如,铁在稀硝酸中腐蚀很快,而在浓硝酸中则腐蚀很慢。1836年,斯柯比称金属在浓硝酸中获得的耐蚀状态为钝态。到目前为止人们对金属的钝化已进行了广泛的研究,并在控制金属腐蚀和提高金属材料的耐蚀性方面发挥了十分重要的作用。
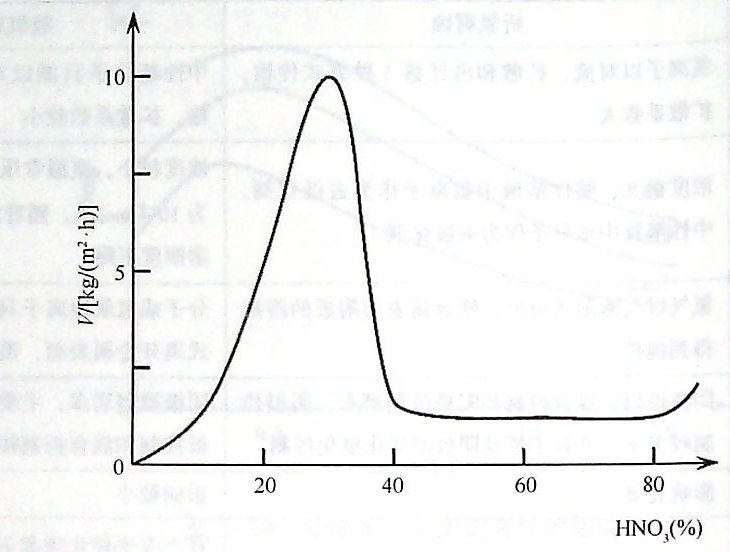
图(1)铁在硝酸中的溶解速率与硝酸的浓度关系
1)化学钝化
将铁片放人硝酸中,观察铁片溶解速率(腐蚀速度)与硝酸浓度的关系,得到如图2-21所示的变化曲线。从图中可以看出,当硝酸浓度较低时,铁的溶解速率随着硝酸的浓度增加而迅速增大。当硝酸浓度增加到为30%—40%时,铁的腐蚀速度达到最大值。硝酸浓度超过40a/o时,铁的溶解速率迅速降低,直到反应接近停止,这一异常现象即为钝化。如果继续增加硝酸浓度,使质量分数超过90qo时,腐蚀速度又有较快的上升,这一现象称为过钝化。经过浓硝酸处理的铁再放人稀硝酸或硫酸中也能保持一定的时间不会受到腐蚀,其原因是金属表面已经发生了钝化。
除铁之外,其他金属如铬、镍、钻、铜、钽、铌、钨、钛等,在适当条件下也会产生钝化。能使金属钝化的物质统称为钝化剂,如浓硝酸、K,Cri0,、KMn0。、KC10。等强氧化剂以及溶液中或大气中的氧。某些非氧化性试剂也能使某些金属钝化,例如镁可在氢氟酸中钝化,钼和铌可在盐酸中钝化,汞和银在CI-的作用下电能发生钝化。

图(2)硫酸罐采用碳钢材质制作主要因为钝化现象
值得注意的是,钝化的发生并不简单地取决于钝化剂氧化能力的强弱。例如,H:0:和KMn0。溶液的氧化还原电位比K,Cr.0,溶液高,是更强的氧化剂,但实际上它们对铁的钝化作用却比后者更弱;Na:S:0。氧化还原电位更高,可是它反而不能使铁钝化。显然,这与阴离子的特性及电位对钝化过程的影n向有关。
综上所述,金属与钝化剂的化学作用而产生的钝化现象称为化学钝化或自钝化。例如,铬、铝、钛等金属在空气中和很多种含氧的溶液中都易被氧钝化,故称为自钝化金属。
金属变为钝态时,其电极电位一般朝正的方向移动。例如,Fe的电位为-0.2-0.2V.钝化后升高到0.5—1.ov;Cr的电位为-0.6~0.4 V,钝化后为0.8~l-0 V。由于电位升高,钝化后的金属失去原有的某些特性,例如钝化后的铁在铜盐中不能将铜置换出来。
- 上一篇:压力20MPa温度160℃浓度20%HCl盐酸浸泡4h试验结 2019/4/22
- 下一篇:氢氟酸防腐蚀用KN17防腐耐磨涂料效果显著 2016/9/5
